Наноорехи переваривают молекулы внутри себя
Почти будничными стали сообщения о создании физиками каких-нибудь мудрёных наноструктур — то «деревьев», то «цветов». Но вот, оказывается, и сама природа может стать конструктором, преподнеся исследователем «на блюдечке» почти готовое наноустройство.
Бери и пользуйся.
Это открытие было сделано случайно. Нынешней весной учёные из американской лаборатории Беркли (Berkeley Lab) проводили опыты с нанокристаллами кобальта (шарики, насчитывающие лишь несколько тысяч атомов) и поместили их как-то в серу.
На первый взгляд, результат был ожидаемый — образовались шарики сульфида кобальта.
Но вот рассмотрев их под электронным микроскопом внимательнее, учёные удивились — это были не шары, а полые сферы.
Ядун Инь (Yadong Yin), ведущий исследование, собрал коллег, и начался мозговой штурм.
В результате решили, что виновником чудесного превращения является эффект Эрнеста Киркендалла (Ernest Kirkendall), открытый в 1947 году, правда работающий здесь не совсем так, как обычно.
А обычно это выглядит так. Соединяют вместе два взаимодействующих твёрдых материала.
Например, два цилиндрика из цинка и меди.
Схема, объясняющая эффект Киркендалла (иллюстрация с сайта lbl.gov).
Их молекулы способны диффундировать. Но проникновение цинка в медь идёт быстрее, чем проникновение меди в цинк.
На границы материалов формируется слой сплава — латуни. Он растёт, но та его граница, что обращена к меди, растёт быстрее.
Казалось бы, и что с того? Оказывается, в таком случае в материале, диффузия которого идёт быстрее (цинк), образуются поры, которые растут и объединяются.
Это и есть эффект Киркендалла.
Происходящее с кобальтом и серой подчинялось тому же правилу. Атомы кобальта смещались к месту встречи живее, чем атомы серы.
Только разворачивались эти события на сферическом фронте и в наномасштабе. Поры внутри кристалла кобальта, покрытого сначала серой, а затем — сульфидом кобальта, вырастали так, что оставалось лишь ядро в центре, связанное с оболочкой тонкими мостиками убегающих молекул.
Потом исчезали и ядро, и мостики, оставляя идеальную сферу с пустотой внутри.
Учёные попробовали повторить процесс с другими парами материалов: кобальт и кислород, железо и кислород, кадмий и сера… Всё повторялось в точности.
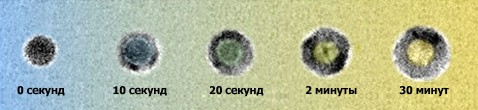
Последовательность образования полых наносфер из сульфида кобальта на снимках с электронного микроскопа (фото с сайта lbl.gov).
Замечательным было и то, что в этом природном производственном процессе сферы получались почти одинаковыми — внутренние пустоты отличались по диаметру не более, чем на 13%.
Тут уж у американских физиков разыгралась фантазия. Таким идеальным сферам нанометрового масштаба можно найти массу применений.
Внутрь можно помещать лекарственные препараты для постепенного выпуска в теле пациента, в оптике и электронике также найдётся, что сделать с такими объектами, а уж химия… Готовый химический реактор, наноколба — разве это не здорово?
При этом для массовой технологии важно, что весь процесс идёт «в одном горшке» — добавил ингредиенты — получил наносферы. Никакого переноса материалов по разным плошкам, никаких потерь.
Всё просто.
Схема убегания атомов кобальта по мостикам — с ядра на внешнюю оболочку (иллюстрация с сайта lbl.gov).
На клич «Посмотрите, что у нас получилось!» прибежали коллеги из других лабораторий и отделов. Химик Габор Соморджей (Gabor Somorjai) предложил: попробуйте поместить внутрь сферы ядро из другого материала, например — платины.
Пусть это будет микрореактор с катализатором.
Но как поместить платину в закрытую со всех сторон сферу, дверцы-то нет?
Придумали многостадийный процесс. Сначала брали зёрна платины. Добавляли наночастицы кобальта, формируя ровную сферу вокруг ядра. Потом — кислород.
Далее всё происходило по знакомому сценарию.
Через некоторое время весь кобальт реагировал с кислородом и убегал наружу, образовывая оксидную «скорлупу ореха», внутри которой свободно бултыхалось платиновое «ядрышко».
Выяснилось, что такой микрореактор, действуя как катализатор, снижает вероятность побочных реакций, повышая выход целевого продукта, по сравнению с платиной, работающей на открытом пространстве — на плоской поверхности или на поверхности пористых губок (как обычно и делаются устройства-катализаторы).
Исходные ядрышки платины и они же — в скорлупе из оксида кобальта (фото с сайта lbl.gov).
Попробовали применить «орехи», как катализаторы в реакции этилена с водородом, и увидели: скрытая платина самым наилучшим образом ускоряла образование этана.
То, что выглядело бы абсурдом в макромасштабе (представьте закрытый сосуд с платиной и исходные продукты снаружи), на наноуровне прекрасно работало.
Однако, как исходные компоненты проникали внутрь «скорлупы» и, как продукт реакции — этан — попадал наружу, осталось пока тайной. Природа-изобретательница не пожелала раскрыть этот патент.
Броуновское движение. Диффузия в жидкостях, газах и твердых телах | Физика 7 класс #5 | Инфоурок