Клетки мышиной печени обойдутся без теломер
Теломеры — образования на концах хромосом — спасают ДНК от разрушения. Если с этими структурами что-то не так, то начинаются старение и разные патологические процессы — это общеизвестный научный факт.
Однако, как показало исследование, немало озадачившее биологов, это не всегда так — иногда теломеры вообще не нужны.
Исследователи под руководством профессора Тиции де Ланге (Titia de Lange) из института Рокфеллера (Rockefeller University) не ставили целью шокировать мировую науку: всего-навсего планировался очередной этап давней серии исследований.
В одной из предыдущих работ де Ланге был открыт важный белковый комплекс шелтерин, обеспечивающий защиту теломер. По словам профессора, опыты с шелтерином проводились над клетками тканей, которые делились. «В этот раз мы просто хотели посмотреть на теломеры в таких клетках, которые не делятся, и не ожидали подобных удивительных результатов», — признаётся Тиция де Ланге.
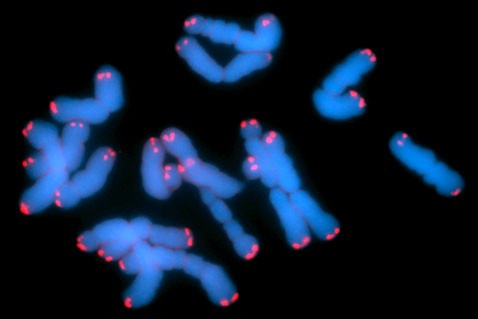
На этом снимке вы можете видеть хромосомы, теломеры которых подсвечены розовым (фото с сайта qmw.ac.uk).
В качестве объекта исследования были выбраны клетки мышиной печени: они удобны для эксперимента, а в их ДНК легко удалить интересующие области. К тому же эти клетки, как правило, не делятся (за исключением тех случаев, когда нужно восстановить повреждённую часть этого органа).
Сначала исследователи удалили TRF2 — важный белок, входящий в состав шелтерина. Учёные ожидали, что это станет причиной дисфункции теломер, которая, в свою очередь (как и во всех предыдущих экспериментах), вызовет клеточную смерть.
Слева — клетки печени обыкновенных мышей. Справа — клетки печени с повреждёнными теломерами после начала регенерации печени.
Как видно, этих клеток не стало больше — вместо этого они сами стали увеличиваться в размерах (иллюстрация с сайта newswire.rockefeller.edu).
И вскоре исследователи увидели то, что хотели увидеть: теломеры не могли защищать хромосому — их как будто бы не было, — и ДНК дала короткий химический «сигнал» о повреждении. Однако клетки не погибли.
А через некоторое время выяснилось, что никаких проблем со здоровьем у мышей не появилось.
«Эрос сказал мне, что мыши чувствуют себя превосходно», — вспомнила де Ланге. Эрос — это имя биолога Лаццерини (Eros Lazzerini), одного из участников этой работы из института молекулярной медицины Скирболла (Skirball Institute of Biomolecular Medicine).
В работе другой исследовательской группы изучались особенности трансгенных мышей, у которых точно таким же образом были нарушены теломеры, но в других органах. У этих животных отмечались серьёзные патологии кожи.
Для сравнения: слева — хвост обычной здоровой мыши; справа — хвосты модифицированных мышей того же вида, которые со временем станут ещё более пигментированными. Теперь биологам придётся поломать голову над вопросом о том, почему ничего подобного не произошло в опытах с печенью (фото R. Munoz, R. Blanco, J. M. Flores, M. A. Blasco).
Наблюдения под микроскопом показали, что хромосомы приклеились друг к другу, собравшись в длинные «поезда» (из-за того, что их концы не были защищены теломерами). Но, несмотря на это, экспрессия генов происходила корректно, нормально создавались все энзимы, нужные печени для растворения жиров, расщепления гормонов и прочей метаболической деятельности.
Ещё интереснее оказались результаты, когда биологи удалили у мышей часть печени, «заставив» тем самым клетки восстанавливать утраченную часть органа. Оказалось, что отсутствие шелтерина не сказалось на регенерации, и мыши «отрастили» недостающие ткани безо всяких осложнений.
Профессор Тиция де Ланге: «Мы были более чем удивлены, когда получили такие результаты» (фото с сайта aacr.org).
Удивительно, но это произошло вовсе не из-за деления. Вместо этого клетки, оставшиеся в целостности, просто выросли в размерах, у них увеличились ядра, и они содержали больше ДНК, чем должно быть в норме.
Но при этом они остались полностью функциональными — никаких патологий.
Тиция де Ланге прокомментировала это так: «Выходит, что клетки печени настолько хорошо умеют приспосабливаться, что без проблем могут воспользоваться другим способом восстановления повреждений».
Но как клетки узнают, что им нужно вести себя именно таким образом? Может ли то же самое наблюдаться у людей?
Пока что ответов на этот вопросы нет. Но это, само собой, не повод останавливаться. «Мы столкнулись с серьёзной загадкой, и нам обязательно надо с ней разобраться», — вот так настроены де Ланге и её коллеги.
Теломераза, клеточное старение и рак © Telomerase, cellular aging and cancer